Substansmängd!
Man har infört en speciell enhet för substansmängd, mol.
Enligt SI-systemet definieras en mol som substansmängden i en portion
av ett ämne som innehåller lika många formelenheter som
12 g C-12 (kol 12 ).
1 mol innehåller 6,022 *1023 formelenheter. Detta tal kallas Avogadros
konstant.
Molmassa
Den massa av ett ämne som motsvarar 1 mol kallas ämnets molmassa,
enhet 1 g/mol.
Med hjälp av nedanståend formel kan man beräkna substansmängden
hos ett ämne.
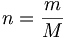
Där:
n = substansmängd ( mol )
m = massa ( g )
M = molmassa ( g/mol )
|
Kalkylator.
|
Några viktiga kemiska formler:
Koncentration:
c = n/V
Massa:
m = M . n
Gasernas allmänna tillståndsekvation:
pV = nRTSamband molvolym:
Molvolym:
V=Vm . n
pH:
pH = -lg ([H+] / mol/dm3)
[H+] = 10-pH . mol/dm3
Värmeenergi;
Q = c . m . Δ T |
Konstanter:
Avogadros konstant:
NA = 6,022 . 1023 mol-1
Allmänna gaskonstanten:
R = 8,314 J . mol –1 . K–1
Molvolymen för en ideal gas vid 25°C och 101,3 kPa :Vm = 24,5
dm3 . mol-1
Vattnets specifika värmekapacitet:
4,18 J . g –1 . K–1 |